Амперометрическое титрование
 АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ (а. amperometric titration; н. amperometrisches Titrieren; ф. titrage amperometrique; и. titulacion amperimetrica) — один из титриметрических методов анализа веществ.
АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ (а. amperometric titration; н. amperometrisches Titrieren; ф. titrage amperometrique; и. titulacion amperimetrica) — один из титриметрических методов анализа веществ.
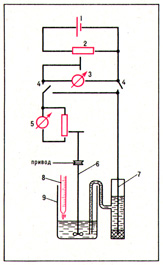
Момент при титровании, когда количество прибавляемого реагента становится строго эквивалентным количеству определяемого вещества, называется точкой эквивалентности, а в эксперименте — конечной точкой титрования. При амперометрическом титровании последнюю находят по изменению силы предельного диффузионного тока (см. Полярография), протекающего через раствор. Метод предложен чешским учёным Я. Гейровским в 1927. На индикаторный электрод (рис. 1) подают такое напряжение, при котором через раствор исследуемого вещества, титранта и продукта их реакции (индикаторные вещества) течёт предельный диффузионный ток. Так как величина последнего пропорциональна концентрации электро- активного вещества, то по мере её изменения в ходе титрования меняется и величина предельного диффузионного тока. При амперометрическом титровании строят график зависимости силы тока от объёма израсходованного титранта. Пересечение двух ветвей кривой титрования соответствует конечной точке.
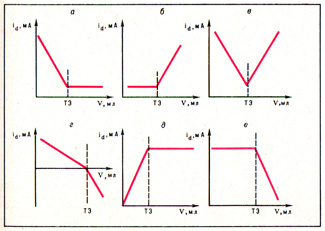
В зависимости от типа реакции при амперометрическом титровании и вещества, которое участвует в электродной реакции, получают различной формы кривых амперометрического титрования. На рис. 2 кривая а соответствует титрованию электрохимически активного вещества раствором неактивного реагента (например, титрование Zn2+, Cd2+, Ni2+ и другим комплексоном III); кривая б — противоположный случай: титрование Mg2+ 8-оксихинолином.
Кривая в построена для случая, когда исследуемое вещество и титрант восстанавливаются на электроде (например, определение Fe3+ а-нитрозо-b-нафтолом). Если на электроде одно вещество восстанавливается, а второе окисляется, форма кривой соответствует г, если взаимодействуют электрохимически неактивное вещество и титрант с образованием электрохимически активного вещества, то получают кривую д (например, титрование арсенатов иодидом калия, при взаимодействии которых образуется электрохимически активный I2). Кривая е соответствует случаю титрования с индикаторами (например, титрование щёлочи кислотой с индикатором из смеси ионов I- и IO3-, приводящее также к образованию электрохимически активного I2).
 Различают амперометрическое титрование с одним и двумя индикаторными электродами. В первом случае в качестве индикаторного используют ртутный капельный или вращающийся платиновый электрод. Электродом сравнения может служить водородный, меркуриодидный, каломельный, меркул-сульфатный или хлор-серебряный электрод. При амперометрическом титровании с двумя индикаторными электродами вместо электрода сравнения используют электрод, который помещают в титруемый раствор. Амперометрическое титрование позволяет выявить 10-6 г вещества в титруемом объёме. Методом амперометрического титрования определяют свыше 60 элементов в различных промышленных и природных материалах, в т.ч. рудах, горных породах и минералах, а также многие органические вещества, например, алкалоиды, альдегиды, амины, кетоны, органические кислоты, красители, сахара, фенолы и др.
Различают амперометрическое титрование с одним и двумя индикаторными электродами. В первом случае в качестве индикаторного используют ртутный капельный или вращающийся платиновый электрод. Электродом сравнения может служить водородный, меркуриодидный, каломельный, меркул-сульфатный или хлор-серебряный электрод. При амперометрическом титровании с двумя индикаторными электродами вместо электрода сравнения используют электрод, который помещают в титруемый раствор. Амперометрическое титрование позволяет выявить 10-6 г вещества в титруемом объёме. Методом амперометрического титрования определяют свыше 60 элементов в различных промышленных и природных материалах, в т.ч. рудах, горных породах и минералах, а также многие органические вещества, например, алкалоиды, альдегиды, амины, кетоны, органические кислоты, красители, сахара, фенолы и др.
