Потенциометрия
 ПОТЕНЦИОМЕТРИЯ (от лат. potentia — сила, мощность и греч. metreo — измеряю * а. potentiometry; н. Potentiometrie; ф. Potentiometrie; и. potenciometria) — электрохимический метод исследования и анализа веществ, основанный на измерении электродвижущих сил (эдс) обратимых гальванических элементов. Потенциометрия используется для изучения кинетики и определения констант устойчивости комплексных соединений, констант диссоциации слабых кислот и оснований, а также произведения растворимости малорастворимых электролитов. Потенциометрия включает редоксметрию и ионометрию. Гальванический элемент, применяемый в потенциометрии, обычно состоит из 2 электродов, которые помещают или в один и тот же раствор (элемент без переноса), или в 2 различных по составу раствора, имеющих между собой жидкостный контакт (элемент с переносом). Элементы без переноса используют для определения изменений термодинамических потенциалов, энтропий, энтальпий и других величин при различных процессах.
ПОТЕНЦИОМЕТРИЯ (от лат. potentia — сила, мощность и греч. metreo — измеряю * а. potentiometry; н. Potentiometrie; ф. Potentiometrie; и. potenciometria) — электрохимический метод исследования и анализа веществ, основанный на измерении электродвижущих сил (эдс) обратимых гальванических элементов. Потенциометрия используется для изучения кинетики и определения констант устойчивости комплексных соединений, констант диссоциации слабых кислот и оснований, а также произведения растворимости малорастворимых электролитов. Потенциометрия включает редоксметрию и ионометрию. Гальванический элемент, применяемый в потенциометрии, обычно состоит из 2 электродов, которые помещают или в один и тот же раствор (элемент без переноса), или в 2 различных по составу раствора, имеющих между собой жидкостный контакт (элемент с переносом). Элементы без переноса используют для определения изменений термодинамических потенциалов, энтропий, энтальпий и других величин при различных процессах.
Электрод, по потенциалу которого судят о концентрации определяемых ионов в растворе, называется индикаторным. Величину потенциала индикаторного электрода определяют, сравнивая её с величиной потенциала другого электрода, который принято называть электродом сравнения. В качестве электрода сравнения может быть применён только такой электрод, величина потенциала которого остаётся неизменной при изменении концентрации определяемых ионов.
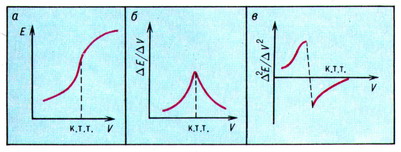
Различают прямую потенциометрию и потенциометрическое титрование (ПТ). Первая используется для непосредственного определения концентрации веществ по значению потенциала индикаторного электрода (рН-метрия, ионометрия). При ПТ в исследуемый раствор, помещённый в потенциометрическую ячейку, опускают индикаторный электрод, возникновение потенциала на котором обусловливается или непосредственно определяемым веществом (если оно электроактивно), или косвенно (если оно неэлектроактивно) в результате его химического взаимодействия с другим потенциалопределяющим компонентом. Конечную точку титрования (КТТ) определяют по скачку потенциала, вызванного заменой одной электрохимической реакции другой до и после КТТ с соответствующим изменением величины потенциала. Этот вариант метода называют ПТ без тока. КТТ удобно определять графически по кривой титрования (рис.).
При работе с необратимыми редокс-системами или компонентами обратимых редокс-систем (в отсутствие сопряжённых форм) потенциал индикаторного электрода устанавливается медленно, он неустойчив. В таких случаях применяют ПТ под током, которое заключается в том, что индикаторный электрод поляризуется, т.е. через него с помощью внешнего источника тока пропускают ток малой величины (несколько микроампер). В этом методе можно использовать 2 идентичных индикаторных электрода, погруженных в титруемый раствор, один из которых поляризуют анодно, а другой — катодно. При этом отпадает необходимость в электроде сравнения, а измеренная эдс соответствует разности потенциалов между 2 электродами. Ход титрования описывается дифференциальной кривой. В ПТ применяют реакции нейтрализации, окисления-восстановления, комплексообразования, осаждения. При использовании техники ультрамикроанализа с помощью ПТ можно определять ~ n 10-10 веществ, например, до 0,4 нг Cu2+ с относительным стандартным отклонением 4-9%. Достоинства ПТ: низкие границы определяемых концентраций, объективность и точность установления КТТ, селективность, возможность титрования в окрашенных и мутных средах, последовательное титрование нескольких компонентов, простота автоматизации. Потенциометрия широко применяется для анализа промышленных и природных материалов, например руд, минералов, т.п., а также объектов окружающей среды. Потенциометрия используется также в автоматизированных системах аналитического контроля технологических потоков на обогатительных фабриках и гидрометаллургических заводах.
