Элементы химические
 ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ (а. chemical elements; н. chemische Elemente; ф. elements chimiques; и. elementos quimiсоs) — составные части простых и сложных тел, представляющие собой совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Каждый элемент химический представляет собой совокупность атомов с одинаковым зарядом ядра (одинаковым атомным, или порядковым номером в периодической таблице Менделеева). У нейтрального атома число электронов в электронной оболочке равно заряду ядра. Известно (1989) 109 элементов химических, из них 89 обнаружены в природе, остальные получены искусственно в результате ядерных реакций (позже атомы технеция, прометия, протактиния, нобелия в ничтожных количествах были обнаружены в урановых и ториевых минералах).
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ (а. chemical elements; н. chemische Elemente; ф. elements chimiques; и. elementos quimiсоs) — составные части простых и сложных тел, представляющие собой совокупность атомов с одинаковым зарядом атомных ядер и одинаковым числом электронов в атомной оболочке. Каждый элемент химический представляет собой совокупность атомов с одинаковым зарядом ядра (одинаковым атомным, или порядковым номером в периодической таблице Менделеева). У нейтрального атома число электронов в электронной оболочке равно заряду ядра. Известно (1989) 109 элементов химических, из них 89 обнаружены в природе, остальные получены искусственно в результате ядерных реакций (позже атомы технеция, прометия, протактиния, нобелия в ничтожных количествах были обнаружены в урановых и ториевых минералах).
Ядро атома состоит из протонов (число которых соответствует атомному номеру элементов химических) и нейтронов; число последних может быть различным. Атом с определённым числом протонов и нейтронов (массовым числом) называется нуклидом. Атомы данного элемента, ядра которых содержат разное число нейтронов, называется изотопами. Элементы химические, имеющие стабильные нуклиды, в природе представлены одним или несколько изотопами. Известно около 270 стабильных изотопов, принадлежащих 81 природному элементу химическому, и свыше 1800 радионуклидов. Элементы химические, все изотопы которых радиоактивны, называется радиоактивными элементами. К ним относятся технеций, прометий, полоний и все элементы с атомным номером большим, чем 84. Природный изотопный состав элементов химических, встречающихся на Земле, практически постоянен, поэтому каждый элемент имеет определённую атомную массу, являющуюся одной из важнейших его характеристик. Атомная масса элементов химических равна среднему значению из масс всех его природных изотопов с учётом распространённости последних. Её обычно выражают в атомных единицах массы, за которую принята 1/12 часть массы нуклида 12С. Формам существования элементов химических в природе соответствуют простые вещества. Элемент может существовать в виде несколько простых веществ (явление аллотропии), отличающихся друг от друга составом молекул (например, кислород O2 и озон O3) или типом кристаллической решётки (например, модификации углерода — алмаз, лонсдэйлеит, графит; явление полиморфизма). Число простых веществ свыше 500. Сложное вещество — химическое соединение. Оно состоит из химически связанных атомов двух или несколько различных элементов. Известно более 100 тысяч неорганических и свыше 3 млн. органических соединений.
Реклама
Для обозначения элементов химических служат химические символы, состоящие из первой или первой и одной из последующих букв латинского названием элемента. Каждый элемент химический характеризуется степенями окисления, которые могут проявлять атомы данного элемента в химических соединениях, а также значением электроотрицательности, характеризующим способность атомов элементов химических отдавать и принимать электроны. В химических реакциях элементы химические сохраняются, так как в результате происходит лишь перераспределение электронов внешних электронных оболочек атомов, а ядра атомов остаются неизменными. Первое научное определение элементов химических как простых веществ, не разлагающихся на составные части, дал английский учёный Р. Бойль в 1661. Первый перечень элементов химических составил в 1789 французским химик А. Л. Лавуазье. В этот список, помимо света, теплорода и "земель" (оксидов кальция, магния, бария, алюминия и кремния), вошли все 25 известных в то время элементов. Первую таблицу относительных атомных масс (отнесённых к массе водорода) 5 элементов химических (кислорода, азота, углерода, серы и фосфора) составил английский учёный Дж. Дальтон в 1803, положив тем самым начало признанию атомной массы как главный характеристики элемента. Последующее быстрое развитие химии привело, в частности, к открытию большого числа элементов химических. Ко времени открытия периодического закона Менделеева (1869) было известно 63 элемента. Открытие Менделеева позволило предвидеть существование, а также свойства ряда неизвестных в то время элементов химических и послужило научной основой для их классификации. Успехи ядерной физики позволили в 20 веке уточнить понятие элементов химических и синтезировать новые — технеций, прометий, астат и все элементы, начиная с атомного номера 93.
По свойствам элементы химические делятся на металлы и неметаллы. К неметаллам относят 23 элемента (Н, В, С, N, О, Si, Р, S, As, Se, Te и др.), галогены (F, Cl, Br, I, At), инертные газы (He, Ne, Ar, Kr, Xe, Rn); к металлам — остальные 86 элементов химических. Для химических свойств металлов наиболее характерна проявляемая при химической реакция способность отдавать внешние электроны и образовывать катионы, для неметаллов — присоединять электроны и образовывать анионы. Электроотрицательность металлов обычно от 0,7 до 1,8-2,0; неметаллов от 1,8-2,0 до 4,0.
При нормальных условиях 2 элемента химических существуют в жидком состоянии (Hg, Br2), 11 — в газообразном (H2, He, N2, O2, F2, Ne, Cl2, Ar, Kr, Xe, Rn), остальные — в виде твёрдых тел, причём температуры их плавления колеблются в очень широком диапазоне от 28,4°С (Cs) и 29,75°С (Ga) до 3420°С (W) и 4492°С (графит при давлении 10,5 МПа).
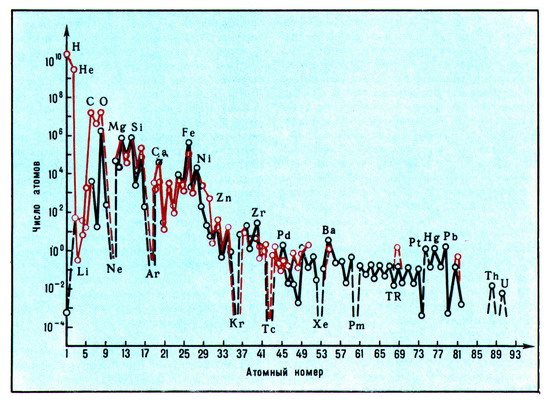
Распространённость и распределение химических элементов (рис.) во Вселенной, процессы объединения и миграции атомов при образовании космического вещества, химические состав космического тел изучаются космохимией.
Основную массу космического вещества составляют водород и гелий (99,9%), распространённость остальных быстро уменьшается с ростом их атомного номера.
Распределение и процессы миграции элементов химических в земной коре и насколько возможно в Земле в целом изучает Геохимия, наиболее разработанная часть космохимии.
Практическая доступность элементов химических определяется их распространённостью в земной коре, а также способностью концентрироваться в результате геохимических процессов. В доступной части Земли (в земной коре) наиболее распространены 10 элементов с атомными номерами в интервале от 8 до 26; О (47,00%), Si (29,50%), Al (8,05%), Fe (4,65%), Ca (3,30%), Na (2,50%), К (2,50%), Mg (1,87%), Ti (0,45%), Mn (0,1%). Перечисленные элементы составляют 99,92% массы земной коры. Элементы химические, концентрация которых в земной коре низка или они практически не образуют собственных минералов (благодаря изоморфному вхождению в минералы более распространённых элементов), называется рассеянными. О свойствах, распространённости в природе, получении и применении элементов химических см. в статьях об отдельных элементах.
