Сурьма
 СУРЬМА, Sb (от тур. sьrme, лат. Stibium * а. antimony; н. Antimon; ф. antimoine; и. antimonio), — химический элемент V группы периодической системы Менделеева, атомный номер 51, атомная масса 121,75. Природная сурьма состоит из смеси 2 стабильных изотопов 121Sb (57,25%) и 123Sb (42,75%). Известно более 20 искусственных радиоактивных изотопов Sb с массовыми числами от 112 до 135.
СУРЬМА, Sb (от тур. sьrme, лат. Stibium * а. antimony; н. Antimon; ф. antimoine; и. antimonio), — химический элемент V группы периодической системы Менделеева, атомный номер 51, атомная масса 121,75. Природная сурьма состоит из смеси 2 стабильных изотопов 121Sb (57,25%) и 123Sb (42,75%). Известно более 20 искусственных радиоактивных изотопов Sb с массовыми числами от 112 до 135.
Сурьма известна с глубокой древности (в 3-м тысячелетия до н.э. в Вавилоне из неё изготовляли сосуды). В Египте в начале 2-го тысячелетия до н.э. порошок антимонита (природный сульфид Sb2S3) применялся в качестве косметического средства. Подробное описание свойств и способ получения сурьмы а также её соединений впервые даны алхимиком Василием Валентином (Германия) в 1604. Французский химик А. Лавуазье (1789) включил сурьму в список химических элементов под названием antimoine.
Сурьма — вещество серебристо-белого цвета с синеватым оттенком и металлическим блеском; известна кристаллическая и 3 аморфные формы сурьмы (взрывчатая, чёрная и жёлтая). Кристаллическая сурьма (также самородная) имеет гексагональную решётку а=0,4506 нм; плотность 6618 кг/м3, t плавления 630,9°С; t кипения 1634°С; теплопроводность 23,0 Вт/(мК); удельная молярная теплоёмкость 25,23 ДжДмоль•К); электрическое сопротивление 41,7•10-4 (Ом•м); температурный коэффициент линейного расширения 15,56•10-6К-1; диамагнитна. Сурьма хрупка, легко раскалывается по плоскостям спайности, истирается в порошок и не поддаётся ковке. Механические свойства сурьмы зависят от её чистоты. Сурьма условно относят к металлам. Взрывчатая сурьма (плотность 5640-5970 кг/м3) взрывается от прикосновения; образуется при электролизе раствора SbCl3. Чёрная сурьма (плотность 5300 кг/м3) получается при быстром охлаждении её паров углеродом; жёлтая модификация — при пропускании кислорода через жидкий гидрид SbH3. Жёлтая и чёрная модификации являются метастабильными образованиями и с течением времени переходят в кристаллическую фазу.
Реклама
Сурьма в соединениях проявляет валентность +5, +3, -3; в химическом отношении малоактивна, на воздухе не окисляется вплоть до температуры плавления. С кислородом сурьма взаимодействует лишь в расплавленном состоянии, образуя Sb2O3; с водородом и азотом при нормальных условиях не реагирует. Активно взаимодействует с галогенами (за исключением F2). Сурьма медленно растворяется в соляной и серной кислотах. При соединении с металлами сурьма образует антимониды. Практический интерес представляют труднорастворимые соли сурьмяной кислоты — антимонаты (V) (Me SbO3•3H2О, где Me — Na, К) и метаантимонаты (III) (Me SbO2•3H2О), обладающие восстановительными свойствами. Сурьма токсична, ПДК 0,5 мг/м3.
Среднее содержание сурьмы в земной коре (кларк) 5•10-5%, в ультраосновных породах 1•10-5%, основных 1•10-4%, кислых 2,6•10-5%. Сурьма концентрируется в гидротермальных месторождениях. Известны собственно сурьмяные, а также сурьмяно-ртутные, сурьмяно-свинцовые, золото-сурьмяные, сурьмяно-вольфрамовые месторождения. Из 27 минералов сурьмы основное промышленное значение имеют: антимонит (Sb2S3), керлизит (Sb2S2), валентинит (Sb2O3), стибиконит Sb Sb2O6•(OH). Благодаря сродству к сере сурьма в виде примесей часто входит в сульфиды мышьяка, висмута, никеля, свинца, ртути, серебра.
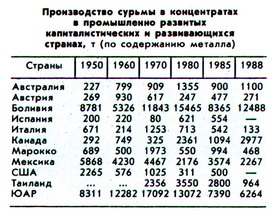
Сурьму получают при пирометаллургической и гидрометаллургической переработке рудных концентратов. Содержание сурьмы в черновом металле свыше 90%. Химически чистую сурьму получают в процессе зонной плавки в инертной атмосфере.
Сурьма в виде сплавов со свинцом и оловом применяется для изготовления пластин аккумуляторных батарей, оболочек кабелей, типографских шрифтов, подшипников; как легирующая добавка к германию, кремнию и другим полупроводниковым материалам. Радиоактивный изотоп Sb используется при изготовлении источников g-излучения и нейтронов.
