Силикаты природные
СИЛИКАТЫ ПРИРОДНЫЕ (от лат. silex, род. падеж silicis — кремень * а. natural silicates; н. naturliche Silikate; ф. silicates naturels; и. silicatos naturales) — класс минералов, солей кремниевой, изо- и гетерополикремниевых кислот. На долю силикатов природных приходится до 75% массы земной коры и около 25% минеральных видов. В природе известно свыше 700 силикатов природных, включая важнейшие породообразующие минералы (полевые шпаты, пироксены, амфиболы, слюды и др.).
Химический состав и структура. В основе кристаллической структуры силикатов природных — солей кремниевой кислоты — лежат одиночные изолированные тетраэдрические радикалы SiО44-; солей изо- и гетерополикремниевых кислот — полимерные радикалы, в которых мостиковые атомы О связывают 2 атома Si смежных SiО4-тетраэдров (в изополикремниевых радикалах) или атомы Т (Т — Si, Al, В, Be, Fe3+ и др.) в TО4-тетраэдрах (в гетерополикремниевых радикалах). В зависимости от атома Т последние получили название алюмо-, боро-, берилло-, ферри- и т.д. силикатов.
Роль катионов в силикатов природных играют преимущественно элементы 2-го, 3-го и 4-го периодов периодической системы Менделеева, среди которых Na, Mg, Al, Fe, К, Ca, Mn наиболее распространены в земной коре и составляют вместе с О и Si до 99% её объёма. Достаточно обычны также силикаты природные Ti, Zn, TR. Менее распространены силикаты V, Ni, Nb, Th, U, Sr, Cs, Ba. Особое место занимают немногочисленные силикаты природные, в которых катионами выступают халькофильные элементы: Cu, Zn, Sn, Pb, As, Sb и Bi.
Большая часть силикатов природных — основные, значительно меньшее их число — кислые и кисло-основные соли; среди силикатов много кристаллогидратов; некоторые силикаты природные (например, слюды) содержат ионы Н3О+. Известны также смешанные соли, содержащие наряду с силикатными радикалами анионы более сильных кислот (СО32-, PО43 SО42-, Cl-, F- и др.).
Реклама
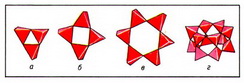 Важнейшая кристаллоструктурная характеристика силикатов природных — строение их анионов, исходя из которого различаются силикаты с островными, цепочечными, ленточными, сеточными и каркасными радикалами. Главнейшие островные кремнекислородные радикалы имеют следующее строение; единичный SiО4-тетраэдр — ортогруппа (например, форстерит); группа из 2 связанных общей вершиной тетраэдров Si2О76- — диортогруппа (гемиморфит); триортогруппа Si3О108- (розенханит); тройное кольцо Si3О96- (рис. 1, а; бенитоит); четверное кольцо Si4О128- (рис. 1, б; баотит); шестерное кольцо Si6О1812- (рис. 1, в; диоптаз); сдвоенное четверное кольцо Si8О208- (эканит); сдвоенное шестерное кольцо Si12О3012- (рис. 1, г; согдианит).
Важнейшая кристаллоструктурная характеристика силикатов природных — строение их анионов, исходя из которого различаются силикаты с островными, цепочечными, ленточными, сеточными и каркасными радикалами. Главнейшие островные кремнекислородные радикалы имеют следующее строение; единичный SiО4-тетраэдр — ортогруппа (например, форстерит); группа из 2 связанных общей вершиной тетраэдров Si2О76- — диортогруппа (гемиморфит); триортогруппа Si3О108- (розенханит); тройное кольцо Si3О96- (рис. 1, а; бенитоит); четверное кольцо Si4О128- (рис. 1, б; баотит); шестерное кольцо Si6О1812- (рис. 1, в; диоптаз); сдвоенное четверное кольцо Si8О208- (эканит); сдвоенное шестерное кольцо Si12О3012- (рис. 1, г; согдианит).
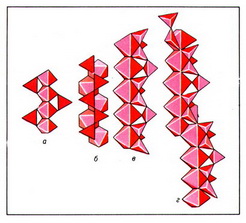
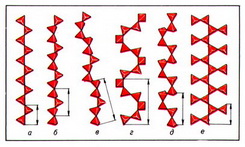 Важнейшие типы цепочечных радикалов в силикатах природных сводятся к следующим: пироксеновая цепочка из параллельно ориентированных диортогрупп с периодом повторяемости в 2 SiО44- -тетраэдра (рис. 2, а); волластонитовая цепочка из чередующихся диортогрупп и одиночных SiО44- -тетраэдров, повёрнутых в другую сторону, с периодом повторяемости в 3 SiО44- -тетраэдра (рис. 2, б); родонитовая цепочка, в которой через 5 SiО44- -тетраэдров происходит сдвиг в сторону (рис. 2, в); стокезитовая цепочка из разноориентированных диортогрупп, связанных SiО44- -тетраэдрами иной ориентации (рис. 2, г); батиситовая зигзагообразная цепочка из вертикальных диортогрупп, поочерёдно смещённых относительно друг друга, с периодом повторяемости в 4 SiО44- -тетраэдра (рис. 2, д); астрофиллитовая зигзагообразная цепочка из горизонтальных диортогрупп (рис. 2, е).
Важнейшие типы цепочечных радикалов в силикатах природных сводятся к следующим: пироксеновая цепочка из параллельно ориентированных диортогрупп с периодом повторяемости в 2 SiО44- -тетраэдра (рис. 2, а); волластонитовая цепочка из чередующихся диортогрупп и одиночных SiО44- -тетраэдров, повёрнутых в другую сторону, с периодом повторяемости в 3 SiО44- -тетраэдра (рис. 2, б); родонитовая цепочка, в которой через 5 SiО44- -тетраэдров происходит сдвиг в сторону (рис. 2, в); стокезитовая цепочка из разноориентированных диортогрупп, связанных SiО44- -тетраэдрами иной ориентации (рис. 2, г); батиситовая зигзагообразная цепочка из вертикальных диортогрупп, поочерёдно смещённых относительно друг друга, с периодом повторяемости в 4 SiО44- -тетраэдра (рис. 2, д); астрофиллитовая зигзагообразная цепочка из горизонтальных диортогрупп (рис. 2, е).
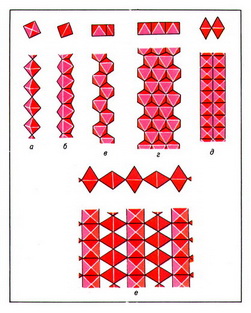
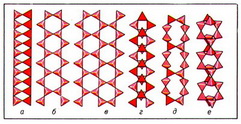 Важнейшие ленточные радикалы: лента силлиманитового типа (рис. 3, а); амфиболовая лента из сдвоенных пироксеновых цепочек (рис. 3, б); джимтомпсонитовая лента из 3 пироксеновых цепочек (рис. 3, в); власовитовая ступенчатая лента из четверных "налезающих" колец SiО44- -тетраэдров (рис. 3, г); ксонотлитовая лента из сдвоенных волластонитоподобных цепочек (рис. 3, д); нарсарсукитовая трубчатая лента из вертикальных диортогрупп с квадратным поперечным сечением (рис. 3, е).
Важнейшие ленточные радикалы: лента силлиманитового типа (рис. 3, а); амфиболовая лента из сдвоенных пироксеновых цепочек (рис. 3, б); джимтомпсонитовая лента из 3 пироксеновых цепочек (рис. 3, в); власовитовая ступенчатая лента из четверных "налезающих" колец SiО44- -тетраэдров (рис. 3, г); ксонотлитовая лента из сдвоенных волластонитоподобных цепочек (рис. 3, д); нарсарсукитовая трубчатая лента из вертикальных диортогрупп с квадратным поперечным сечением (рис. 3, е).
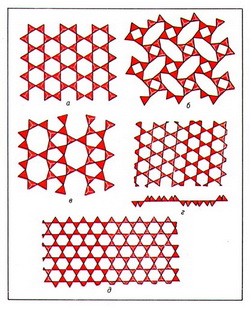
Цепочки и ленты SiО44- -тетраэдров поликонденсируются в сетки (слои), которые могут быть полярными (рис. 4, а), или двусторонними (рис. 4, б-д).
Предельной степенью поликонденсации является соединение TО44--тетраэдров всеми своими вершинами друг с другом, при котором возникает каркасная структура.
 Координационные числа (КЧ) катионов в силикатов природных с ионной связью меняются от 4 (Be, Al, Li, Fe3+, Cr3+, Mg) до 9-12 (К, Rb, Sr, Ca, Ba). Ковалентной связью характеризуется меньшее число катионов (Cu, Zn, Pb, As, Sb, Bi и др.), для них КЧ определяется типом гибридизации. В структурах силикатов, содержащих катионы с КЧ-6, выделяются различные мотивы катионных полиэдров от островных октаэдрических групп через цепочки, ленты до стенок (рис. 5, а-г).
Координационные числа (КЧ) катионов в силикатов природных с ионной связью меняются от 4 (Be, Al, Li, Fe3+, Cr3+, Mg) до 9-12 (К, Rb, Sr, Ca, Ba). Ковалентной связью характеризуется меньшее число катионов (Cu, Zn, Pb, As, Sb, Bi и др.), для них КЧ определяется типом гибридизации. В структурах силикатов, содержащих катионы с КЧ-6, выделяются различные мотивы катионных полиэдров от островных октаэдрических групп через цепочки, ленты до стенок (рис. 5, а-г).
Соответствие силы определённой кремниевой кислоты силе катиона заключается в соразмерности величины катиона расстояниям между концевыми атомами О2- в Тт,On-радикале. Поэтому небольшие катионные тетраэдры, образуемые ионами Be, Al, соединяясь с SiО44- -тетраэдрами, образуют с последними единый структурный мотив берилло- и алюмосиликатов. Небольшие октаэдрического полиэдры (типичные для Mg, Fe2+ и т.п. катионов) сопрягаются с концевыми атомами О2- одиночных SiО44- -тетраэдров (рис. 6, а), полимерных кремнекислородных (рис. 6, б), алюмо-кремнекислородных и т.п. радикалов.
Увеличение размера катионных октаэдров вызывает необходимость поликонденсации SiО44- -тетраэдров в цепочки (рис. 6, в, г) и более сложные кремнекислородные радикалы — ленты, сетки (слои), каркасы. Полимерные кольцевые, цепочечные, ленточные и сеточные радикалы имеют дополнительные возможности приспособления к различным катионным полиэдрам за счёт изменения угла сопряжения SiО44- тетраэдров между собой.
Систематика. В зависимости от силовых характеристик (CX) катионов (In/ropбn+ или In/ri, где In — n-й потенциал ионизации; ropбn+ — орбитальный радиус иона с валентностью n; ri — эффективный ионный радиус катиона в ионном кристалле) класс силикатов природных в химико-структурной систематике делится на 3 подкласса: I — силикаты, содержащие катионы с низкими CX (К, Na, Li, Mg, Fe2+, Fe3+ и др.); II — со средними CX (Ti, Zn и др.) — титано- и цирконосиликаты; III — силикаты халькофильных элементов.
 По типу гетерополианионного радикала в каждом из подклассов выделяют сектора (бериллосиликаты, алюмосиликаты, боросиликаты, собственно силикаты).
По типу гетерополианионного радикала в каждом из подклассов выделяют сектора (бериллосиликаты, алюмосиликаты, боросиликаты, собственно силикаты).
В зависимости от степени поликонденсации TО4-тетраэдров в анионных радикалах различают 9 надотделов: тетрасиликаты (ортосиликаты) с радикалом SiО44- (например, оливины); тетратрисиликаты (ортодиортосиликаты), содержащие одновременно, например, SiО44-- и Si2О76--радикалы (эпидот); трисиликаты (диортосиликаты) с радикалом Si2О76- (тортвейтит); тридисиликаты (например, розенханит); дисиликаты (метасиликаты) с радикалами SiО3N2n- (диопсид); димоносиликаты с радикалами типа Si4О116-, AlSi3О117- и др. (например, тремолит); моносиликаты с радикалами Si2О5N2n- (каолинит); мононульсиликаты (родезит); нульалюмосиликаты с радикалами типа Tn3+Si1-nО2n- (альбит). Принадлежность силикатов к средним, основным, кислым солям или кристаллогидратам позволяет выделять отделы. Более дробная систематика основывается на структурных признаках с учётом геометрии анионного мотива (отряды островных, цепочечных, сеточных или слоистых, каркасных силикатов природных) анионного и катионного субмотива (подотряды субкаркасных, субцепочечных и т.д. силикатов).
Свойства. Большинство силикатов природных из-за сложности состава имеют низкую симметрию. Около 45% из них относится к моноклинной, 20% — к ромбической, 9% — к триклинной (к низшим сингониям относятся прежде всего многие цепочечные, слоистые силикаты и каркасные алюмосиликаты), 7% — к тетрагональной, 10% — к тригональной и гексагональной (силикаты с кольцевыми треугольными и гексагональными радикалами) и 9% — к кубической (тетрасиликаты с изолированными SiО44--тетраэдрами; ряд каркасных нульалюмосиликатов) сингонии.
Большая часть силикатов бесцветные или белые; силикаты Fe, Mn, Ni, UО22+, Ti, Zr, V, Cu, TR и некоторых других элементов (а также содержащие их в виде изоморфных примесей) часто окрашены в различные цвета. Блеск стеклянный до алмазного. В тонких шлифах прозрачны. Многие силикатов природные обладают совершенной спайностью в трёх направлениях, для цепочечных и ленточных силикатов характерна спайность в двух направлениях, для слоистых — весьма совершенная спайность в одном направлении. Большинство силикатов (минералы с лёгкими катионами De, Mg, Al, каркасной и слоистой структурой) имеют низкую плотность (2000-3000 кг/м3), которая возрастает до 3500 и даже 4000 кг/м3 у тетрасиликатов с островными SiО4-тетраэдрами и до 6500 кг/м3 у силикатов тяжёлых элементов (например, свинца). Твердость максимальная (до 6-8) у некоторых каркасных алюмосиликатов и силикатов с островной и цепочечной структурой снижается до 4-5 у большинства силикатов халькофильных элементов и до 1-2 у слоистых минералов. Показатели преломления силикатов в целом пропорциональны их плотности и колеблются в широких пределах.
Образование. Силикаты природные — полигенные минералы. В магматических породах нормального ряда от ультраосновных до кислых подавляющая роль принадлежит силикатам и алюмосиликатам катионов с низкими CX, тогда как силикаты с катионами, имеющими средние CX, известны в них в виде акцессорных минералов (циркон, титанит). В агпаитовых щелочных породах содержится большое число каркасных алюмосиликатов (полевые шпаты, фельдшпатиды), находящихся в тесной ассоциации с натриевыми пироксенами (эгирин, эгирин-авгит) и различными сложными силикатами Ti и Zr. Для пегматитов характерны силикаты катионов Na, К, Li, Cs, Be. Гидротермальным путём, а также при повышенном содержании в магме H2О образуются фельдшпатиды и цеолиты. Силикаты халькофильных элементов (хризоколла, виллемит, гемиморфит, диоптаз и др.) типичны для зон окисления рудных месторождений.
Силикатные ассоциации, образующиеся при метаморфизме глинистых пород, представлены высокоглинозёмными минералами (андалузитом, кианитом, силлиманитом, ставролитом, кордиеритом, альмандином, хлоритоидом и др.); при метаморфизме карбонатных пород — волластонитом, андрадитом, гроссуляром, диопсидом, тремолитом и другими силикатами Ca и Mg(Fe2+).
Влияние температуры и давления на характер образующихся минеральных ассоциаций обусловлено главным образом кристаллохимической спецификой отдельных силикатов. Последовательность магматической кристаллизации (по Н. Л. Боуэну) начинается с наиболее тугоплавких тетрасиликатов Mg и Fe2+ — оливинов, на смену которым приходят пироксены — цепочечные дисиликаты, затем амфиболы — основные ленточные ди-моносиликаты, полевые шпаты — каркасные нульалюмосиликаты и, наконец, нульсиликат — SiО2.
При метаморфизме на первых ступенях появляются каркасные нульалюмосиликаты (цеолиты, полевые шпаты), к которым затем присоединяются сеточные моноалюмосиликаты (слюды, хлориты), ленточные ди-моносиликаты (амфиболы), цепочечные дисиликаты (пироксены). Для средних ступеней метаморфизма характерны островные тетра-трисиликаты (эпидот, цоизит и др.), а для глубинных ступеней — островные тетрасиликаты (гранаты, оливины, кианит).
Парциальное давление (активность) H2О-PH2О определяет, прежде всего, степень гидролиза силикатов. Типичные ранние продукты гидролиза алюмосиликатов — слюды, при достаточной активности Mg, Al и относительно высокой температуре возникают хлориты (особенно по тетрасиликатам), а в условиях высокой активности К+ — мусковит. При более низкой температуре и высокой активности Mg, Al, Ca, Na образуются смешаннослойные хлорит-смектиты, которые при понижении температуры замещаются смектитами. При высокой активности К+ образуются иллиты, затем иллит-смектиты и смектиты. В условиях высокой активности Mg возникают вермукулиты, которые затем замещаются смешаннослойными вермикулитами-смектитами и смектитами. В гидротермальных системах, отличающихся высокой активностью угольной кислоты, более сильной, чем кремниевые, возникают ассоциации, для которых из силикатов природных характерны только полевые шпаты в высокотемпературных жилах, слюды, хлориты, каолинит.
